1. Cơ chế của ELISA là gì?
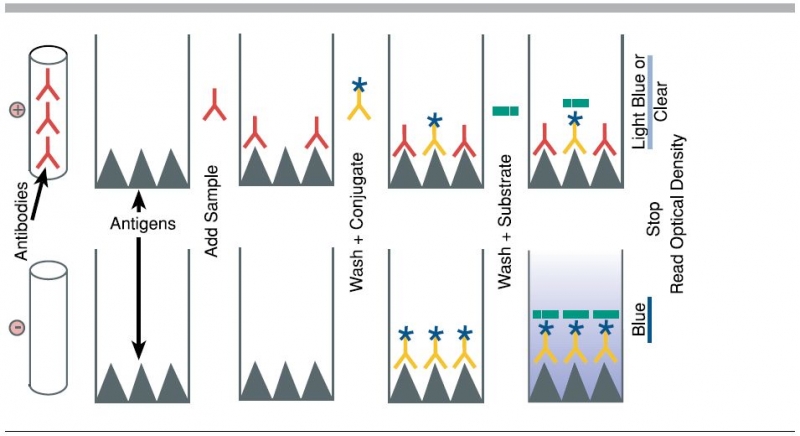
Để thực hiện một phản ứng ELISA bao gồm ít nhất một kháng thể bắt cặp đặc hiệu với kháng nguyên cụ thể. Các mẫu có số lượng kháng nguyên chưa biết được cố định trên một bề mặt vững chắc- giá thể rắn (thường là một tấm polystyrene vi chuẩn) hoặc không đặc hiệu (thông qua hấp phụ lên bề mặt) hoặc đặc hiệu (thông qua chụp bằng kháng thể khác đặc hiệu với kháng nguyên tương tự trong thí nghiệm ELISA sandwich).
Sau khi kháng nguyên được cố định, các kháng thể phát hiện được thêm vào, tạo thành một phức hợp với các kháng nguyên. Các kháng thể phát hiện có thể liên kết với một loại enzyme, hay chính nó có thể được phát hiện bởi một kháng thể thứ cấp liên kết với một loại enzyme thông qua liên kết cộng hóa trị giữa các phân tử sinh học. Các phần của kháng thể ELISA là tương tự với phương pháp western blot. Giữa mỗi bước, các đĩa thường được rửa bằng dung dịch tẩy nhẹ để loại bỏ các protein hoặc các kháng thể không gắn. Sau bước rửa cuối cùng, cơ chất của enzyme được thêm vào để tạo ra tín hiệu có thể nhìn thấy, giúp chỉ ra số lượng kháng nguyên trong mẫu.
2. Thiết bị cần thiết cho một phản ứng ELISA
- Đĩa ELISA pha rắn

Đĩa ELISA 96 giếng được sử dụng nhiều nhất trong ELISA thường là polystyrene hoặc các dẫn xuất của polystyrene thu được bằng cách biến đổi hóa học hoặc chiếu xạ bề mặt. Phổ biến nhất là đĩa 96 giếng được tổ chức thành 8 hàng và 12 cột. Mỗi giếng giữ khoảng 350 µl thể tích với một khu vực bên trong khoảng 2,5 cm2. Gần đây hơn, đĩa 384 giếng và 1536 giếng đã được phát triển với kích thước tổng thể giống như truyền thống 96 giếng. Chúng được sử dụng trong việc kiểm tra lượng mẫu lớn. Ngoài ra, cũng có đĩa 96 giếng với giếng bằng một nửa thể tích giếng truyền thống. Phân tích được thực hiện trong các giếng với thể tích bằng một nửa này là giống hệt về hiệu suất với đĩa kích thước truyền thống, nhưng tiết kiệm đáng kể về thành phần phản ứng. Một sự đổi mới gần đây cũng đã đề nghị làm tròn phần đáy giếng thay vì ở một góc 90 độ. Điều này đã giúp cho việc rửa dễ dàng hơn và tăng hiệu quả rửa.
- ELISA Pipet

Có 2 loại pipet thường được sử dụng là pipet đa kênh và pipet đơn kênh. Pipet đơn kênh chia làm 2 dạng: cố định thể tích và điều chỉnh thể tích (1- 20 ml, 10- 100 ml, 20- 200 ml..), còn pipet đa kênh thường được dùng là loại 8 đầu tip và 12 đầu tip để phù hợp với số lượng hàng và cột của đĩa ELISA. Về thao tác có thể chia thành pipet phân phối bán tự động và pipet phân phối hoàn toàn tự động.
- Hệ thống máy rửa
Hệ thống máy rửa ELISA có thể chia thành các loại như sau: có thể rửa một hàng hoặc cột tại một thời điểm, có thể rửa một lúc cả đĩa hoặc rửa một lần nhiều đĩa. Tùy thuộc vào mục đích công việc mà ta lựa chọn loại máy phù hợp.
- Máy đọc kết quả ELISA
Tương tự máy rửa ELISA, máy đọc ELISA cũng chia thành 3 nhóm: có thể đọc một hàng hoặc cột trong một lần, có thể đọc kết quả của cả đĩa cùng một lần hoặc đọc kết quả nhiều đĩa cùng một lúc.
3. Các loại ELISA
a) Direct ELISA ( ELISA trực tiếp) - Đơn giản và tiết kiệm thời gian
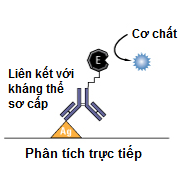
Phương pháp ELISA trực tiếp được coi là loại đơn giản nhất trong các phương pháp ELISA, kháng nguyên (Antigen- Ag) được hấp phụ lên một tấm nhựa, sau đó một lượng lớn của một loại protein (thường là albumin huyết thanh bò- BSA) được thêm vào để khóa tất cả các vị trí liên kết khác. Trong lúc đó, một loại enzyme sẽ liên kết với một kháng thể trong một phản ứng riêng biệt, phức hợp enzyme- kháng thể này được sử dụng để hấp phụ các kháng nguyên. Sau khi phức enzyme- kháng thể dư thừa bị loại bỏ hết, phức hợp enzyme- kháng thể nào gắn với kháng nguyên sẽ còn lại trên giếng. Bằng cách thêm vào cơ chất của enzyme, tín hiệu phát ra đại diện cho lượng kháng nguyên trong mẫu.
Tuy nhiên, so sánh ELISA trực tiếp với ELISA gián tiếp về mặt kỹ thuật thì thấy, trong ELISA gián tiếp, các bước tiến hành cũng tương tự nhưng có những khác biệt quan trọng và có thêm một bước bổ sung. Sau khi kháng nguyên được hấp thụ vào các đĩa, và sau bước cho BSA, các kháng thể tiếp theo sẽ được thêm vào là các kháng thể có thể nhận diện các kháng nguyên (kháng thể này không gắn enzyme). Sau đó, một kháng thể gắn enzyme đã được chuẩn bị và thêm vào đĩa nhằm phát hiện các kháng thể hấp phụ với kháng nguyên (còn trong ELISA trực tiếp, phức hệ kháng thể- enzyme sẽ trực tiếp hấp thụ với kháng nguyên).
So với các phương pháp ELISA khác, phương pháp này được thực hiện trong thời gian ngắn hơn vì chỉ có một kháng thể được sử dụng và ít bước tiến hành hơn. Điều này có thể được sử dụng để kiểm tra phản ứng kháng thể - kháng nguyên cụ thể, và giúp loại bỏ phản ứng chéo giữa các kháng thể khác.
Các kháng thể chính phải được đánh dấu riêng, nên tốn nhiều thời gian và không linh hoạt khi thực hiện nhiều thí nghiệm.
Ngoài ra, kỹ thuật này có độ nhạy thấp hơn do các tín hiệu được khuếch đại ít hơn, nghĩa là độ nhạy thấp hơn.
b) ELISA gián tiếp (Indirect ELISA)- Thông dụng nhưng hiệu quả
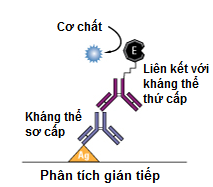
Phương pháp ELISA gián tiếp bao gồm hai bước ELISA liên quan đến hai quá trình gắn của kháng thể sơ cấp và kháng thể thứ cấp được đánh dấu. Kháng thể sơ cấp được ủ với kháng nguyên và sau đó là ủ với kháng thể thứ cấp. Tuy nhiên, việc này có thể dẫn đến các tín hiệu không đặc hiệu bởi vì xảy ra các phản ứng chéo của kháng thể thứ cấp.
Các bước cơ bản trong ELISA gián tiếp:
1. Các đĩa giếng được ủ với kháng nguyên, rửa và khóa bằng BSA.
2. Thêm mẫu và kháng thể vào và rửa.
3. Enzyme gắn với kháng thể thứ cấp được thêm vào và rửa.
4. Thêm cơ chất, enzyme trên kháng thể tạo ra tín hiệu màu hoặc huỳnh quang.
+ Độ nhạy cao: Nhiều hơn một kháng thể được đánh dấu và gắn trên mỗi phân tử kháng nguyên.
+ Linh động: Nhiều kháng thể sơ cấp khác nhau có thể được dùng với một kháng thể thứ cấp có đánh dấu.
+ Tiết kiệm: Kháng thể thứ cấp được đánh dấu được dùng ít hơn.
Trong phân tích ELISA gián tiếp, kháng thể của mẫu được kẹp theo dạng sandwich ở giữa kháng nguyên trên đĩa và enzyme đánh dấu, liên kết kháng đặc hiệu globulin. Việc thêm cơ chất của enzyme vào tạo ra phản ứng màu. Cường độ màu tỉ lệ thuận với lượng kháng thể của mẫu. Mẫu càng nhiều kháng thể, cường độ màu càng mạnh. ELISA gián tiếp phù hợp cho việc xác định mức độ tổng kháng thể có trong mẫu.
c) ELISA sandwich - Độ nhạy cao
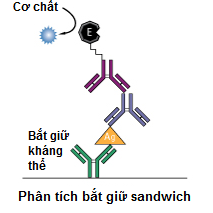
ELISA sandwich là một loại ít phổ biến của kỹ thuật ELISA, nhưng rất hiệu quả trong việc phát hiện kháng nguyên trong mẫu. Hơn nữa, nhiều bộ kit thương mại ELISA được xây dựng dựa trên loại ELISA này.
ELISA sandwich định lượng kháng nguyên giữa hai lớp kháng thể (kháng thể bắt- capture và phát hiện- detection). Các kháng nguyên được định lượng phải chứa ít nhất hai epitope kháng nguyên có khả năng liên kết với các kháng thể, ít nhất là với hai kháng thể hoạt động trong kỹ thuật sandwich. Các kháng thể đơn dòng hoặc đa dòng đều có thể được sử dụng như là các kháng thể bắt và kháng thể phát hiện trong hệ thống ELISA sandwich. Kháng thể đơn dòng có một epitope duy nhất cho phép phát hiện và định lượng tốt sự khác biệt nhỏ trong kháng nguyên. Một kháng thể đa dòng thường được sử dụng như các kháng thể bắt giữ càng nhiều kháng nguyên càng tốt. (Epitope- Quyết định kháng nguyên, là vị trí trên kháng nguyên, nơi gắn với kháng thể).
Quy trình ELISA sandwich có thể khó khăn để tối ưu hóa và cần phải kiểm tra các kháng thể bắt cặp sai. Điều này đảm bảo các kháng thể này phát hiện được các epitope khác nhau trên một protein đích để chúng không cản trở các kháng thể đang gắn.
Các bước thực hiện:
Những hình ảnh ở phía dưới bao gồm việc sử dụng một kháng thể thứ cấp liên kết với enzyme, mặc dù, theo phương diện kỹ thuật, điều này là không cần thiết nếu các kháng thể sơ cấp liên kết với enzyme. Tuy nhiên, việc sử dụng một liên kết kháng thể thứ cấp sẽ tránh được quá trình tốn kém của việc tạo ra các kháng thể liên kết enzyme cho mỗi kháng nguyên mà người ta muốn phát hiện.
Bằng cách sử dụng một kháng thể liên kết enzyme liên kết với các khu vực Fc của kháng thể khác, một kháng thể liên kết enzyme giống như vậy có thể được sử dụng cho một loạt các thí nghiệm. Nếu không có kháng thể bắt giữ ở lớp đầu tiên, bất kỳ protein trong mẫu (bao gồm các protein huyết thanh) cũng có thể hấp phụ lên bề mặt đĩa, làm giảm số lượng kháng nguyên cố định được. Sử dụng các kháng thể đặc hiệu đã được tinh sạch để gắn với các kháng nguyên trong đĩa sẽ giúp giảm bớt việc làm sạch kháng nguyên từ một hỗn hợp phức tạp trước khi định lượng, đơn giản hóa phân tích và tăng độ đặc hiệu và độ nhạy của thí nghiệm ELISA sandwich.
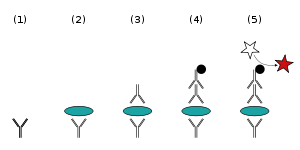
Quy trình ELISA sandwich
(1) Đĩa được phủ một lớp kháng thể bắt giữ; (2) Thêm mẫu, bất kì kháng nguyên nào có mặt sẽ liên kết với kháng thể bắt giữ; (3) Kháng thể phát hiện được thêm vào, và gắn với kháng nguyên; (4) Kháng thể thứ cấp liên kết enzyme được thêm vào, và gắn với kháng thể phát hiện; (5) Thêm cơ chất của enzyme và phát tín hiệu.
+ Mẫu không cần phải được tinh sạch trước khi phân tích.
+ Độ đặc hiệu cao, vì sử dụng hai kháng thể nên các kháng nguyên/ chất phân tích được bắt và phát hiện đặc hiệu.
+ Thích hợp cho các mẫu phức tạp, bới vì các kháng nguyên không yêu cầu đòi hỏi phải tinh sạch trước khi tiến hành định lượng.
+ Linh hoạt và độ nhạy cao, vì cả hai phương pháp phát hiện trực tiếp và gián tiếp đều có thể được sử dụng. Độ nhạy cao hơn 2-5 lần so với phương pháp ELISA trực tiếp hoặc gián tiếp, nhưng thấp hơn ELISpot.
d) ELISA cạnh tranh: Nguyên tắc cơ bản
Vấn đề chủ yếu của ELISA cạnh tranh là quá trình gắn cạnh tranh thực hiện bởi kháng nguyên gốc (kháng nguyên mẫu) và kháng nguyên được thêm vào. Quy trình của phương pháp ELISA cạnh tranh khác một vài điểm so với ELISA gián tiếp, ELISA sandwich và ELISA trực tiếp.
Một quy trình đơn giản như sau:
1. Kháng thể chính- sơ cấp (chưa đánh dấu) được ủ với kháng nguyên mẫu.
2. Phức hợp kháng thể- kháng nguyên sau đó được thêm vào đĩa 96 giếng đã được phủ trước các kháng nguyên tương tự.
3. Kháng thể không bám được sẽ bị loại bỏ thông qua bước rửa đĩa. (Càng nhiều kháng nguyên trong mẫu, càng ít kháng thể sẽ có thể liên kết với các kháng nguyên trong giếng, do đó gọi là "cạnh tranh".)
4. Các kháng thể thứ cấp gắn enzym mà đặc hiệu với các kháng thể sơ cấp sẽ được thêm vào.
5. Thêm cơ chất, enzyme phân giải cơ chất và tạo tín hiệu màu hoặc huỳnh quang.
Đối với phương pháp ELISA cạnh tranh, nồng độ kháng nguyên mẫu càng cao, các tín hiệu cuối cùng càng yếu. Ưu điểm chính của phương pháp này là khả năng sử dụng các mẫu thô hoặc không tinh khiết mà vẫn gắn chọn lọc bất kỳ kháng nguyên nào có mặt. (Lưu ý rằng một số bộ kit ELISA cạnh tranh bao gồm kháng nguyên gắn enzyme nhiều hơn là kháng thể gắn enzyme. Kháng nguyên đánh dấu sẽ cạnh tranh vị trí gắn với kháng thể sơ cấp với kháng nguyên trong mẫu (kháng nguyên này không đánh dấu). Kháng nguyên trong mẫu càng nhiều thì càng ít kháng nguyên đánh dấu được giữ lại trong giếng và tín hiệu càng yếu).
+ Độ đặc hiệu cao, sử dụng hai kháng thể nên các kháng nguyên/ chất phân tích được giữ và phát hiện.
+ Thích hợp cho các mẫu phức tạp, vì các kháng nguyên không đòi hỏi tinh sạch trước khi tiến hành phản ứng.
+ Tính linh hoạt và độ nhạy cao.
+ Phát hiện được lượng kháng nguyên ít - kháng nguyên càng ít tín hiệu càng mạnh.
4. Ứng dụng của kỹ thuật ELISA
Nếu một protein với nhiều epitope được phát hiện, thử nghiệm sandwich là một lựa chọn tốt. Thử nghiệm này đòi hỏi hai kháng thể phản ứng với các epitope khác nhau. Tuy nhiên, nếu các phân tử có nhiều epitope lặp đi lặp lại, trong một thử nghiệm sandwich chúng ta có thể sử dụng các kháng thể tương tự cho cả việc bắt kháng nguyên (capture) và phát hiện (detection). Ngoài ra, nếu có nguồn các chất cần phát hiện ở dạng tinh sạch mà có thể được hấp thu một cách hiệu quả trong giếng, người ta có thể thiết lập kỹ thuật ELISA cạnh tranh, trong đó chất cần phân tích dạng tinh khiết được cố định sẽ cạnh tranh với chất phân tích trong mẫu để liên kết với các kháng thể được đánh dấu. Trong trường hợp này chuẩn độ kháng thể là điều cần thiết, nếu không độ nhạy thí nghiệm sẽ bị giảm.
Đĩa polystyrene sẽ giữ một loạt các protein với số lượng tăng dần tùy thuộc vào nồng độ của chúng trong dung dịch. Số lượng cụ thể và tối ưu cần được xác định cho mỗi protein, nhưng một số quan sát chung đã được thực hiện đối với các kháng thể. Đĩa có độ bám từ trung bình đến thấp có thể gắn 100-200 ng IgG/cm2, trong khi đĩa có độ bám cao thường có thể gắn lên đến 400-500 ng IgG/cm2. Ngoài protein, đĩa polystyrene còn hấp thụ các peptide có chiều dài từ 15 - 20 axit amin. Để đạt được liên kết mạnh, một peptide sẽ cần cả hai tương tác kỵ nước và ưa nước. Thông thường, nhược điểm để hấp phụ peptide trực tiếp là chúng có xu hướng có ít epitope, và nếu chúng tương tác với nhựa, việc bắt của kháng thể sẽ gặp khó khăn. Một giải pháp khác là gắn các peptide lên một protein lớn hơn thông qua một đoạn spacer- nhằm cung cấp khoảng cách giữa các peptide và protein, cho phép các kháng thể tương tác được với các peptide.
Xét nghiệm một sinh vật chẳng hạn như phát hiện một tế bào vi khuẩn hay virus cũng có thể sử dụng kỹ thuật ELISA sandwich với kháng thể tương tự cho cả bắt và phát hiện. Nếu các phân tử đích là hoặc chỉ có một epitope duy nhất, cần thay đổi các phần đã mô tả ở trên. Bản thân các phân tử nhỏ hoặc không hấp thu tốt với pha rắn, hoặc có thể bị che phủ bởi các protein được thêm vào, vì vậy, các phân tử nhỏ thường có thể được gắn vào các protein lớn hơn, cung cấp một phương tiện để gắn các epitope mong muốn với pha rắn, tạo ra một cấu hình cho phép các epitope bị bắt bởi một kháng thể.
Carbohydrate và protein bị glycosyl hóa nhiều sẽ không hấp thu tốt với polystyrene bởi các lực được mô tả ở trên, vì chúng có rất ít khả năng tham gia vào các tương tác kỵ nước. Protein màng tế bào sản sinh từ các tế bào và duy trì trong dung dịch bằng chất tẩy rửa cũng không được hấp thụ tốt khi có sự hiện diện của các chất tẩy rửa. Sử dụng liên kết cộng hóa trị hoặc giảm nồng độ chất tẩy rửa là cách tốt nhất để gắn các protein này. Trong thực tế, liên kết cộng hóa trị có thể được thực hiện trong sự hiện diện của các chất tẩy rửa như Tween-20 và Triton X-100.
Nguồn: https://biomedia.vn/